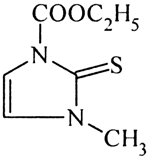
karbimazol
Karbimazol (1-etoksykarbonylo-3-metylo-2-trio-4-imidazolina) Spofa. Stosowano odczynniki supra pure firmy Merck. Woda używana do badań była redestylowana i oczyszczana dodatkowo za pomocą Nanopure Deionization System (Barnsted).

Elektrochemiczna mikrowaga kwarcowa M105 (UELKO), woltamperometr uAutolab (Eco Chemie) sterowany komputerowo z oprogramowaniem GPES (General Purpose Elektrochemical System, v 4.5). Elektrodę pracującą, w badaniach EQCM, stanowiły 10 MHz kryształy kwarcu z próżniowo napylonymi elektrodami złotymi o grubości około 900 A i powierzchni czynnej około 0,25 cm2 (International Crystal Mfg. Co). Kryształy mocowano do dna naczynka elektrochemicznego za pomocą kleju silikonowego General Electric. W badaniach woltamperometrycznych stosowano dyskową elektrodę złotą (A=0,12cm2), z węgla szklistego (A=0,12cm2) i elektrodę platynową (A=0,12cm2) firmy BAS. Elektrodą odniesienia była nasycona elektroda kalomelowa (SCE), a trzecią elektrodę stanowił zwinięty w spiralę drut platynowy. Tlen z roztworu usuwano w ciągu 15 minut. Badania prowadzono w temperaturze około 20 st C. Elektrody dyskowe szlifowano przed każdym pomiarem za pomocą 0,05u Al2O3 (Union Carbide) na płótnie polerskim (Buehler), a następnie płukano wodą i etanolem 95%.
Omówienie wyników i wnioskiMetodą woltamperometrii cyklicznej zbadano elektroaktywność karbimazolu na dyskowych elektrodach złotej (AuE), platynowej (PtE) i z węgla szklistego (GCE) w różnych elektrolitach podstawowych, buforowych i niebuforowych w zakresie pH od 1 do 13. Najlepiej ukształtowane i powtarzalne krzywe uzyskano na elektrodzie Au w 0,1 mol dm-3 roztworze H2SO4 i elektrodzie Pt w 0,1 mol dm-3 roztworze KCl oraz buforze octanowym o pH 4,3. Kształt uzyskiwanych woltamperografów zależny był od stężenia depolaryzatora, czasu cyklowania i od zakresu potencjałów, w jakim wykonywano badanie.
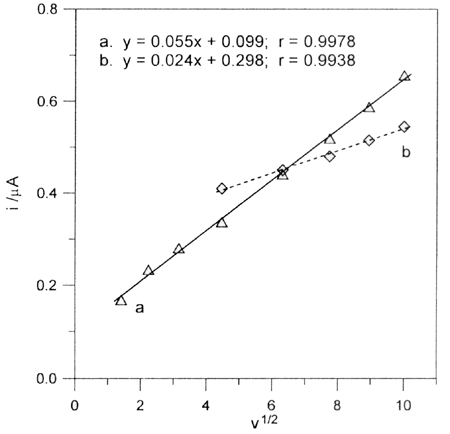
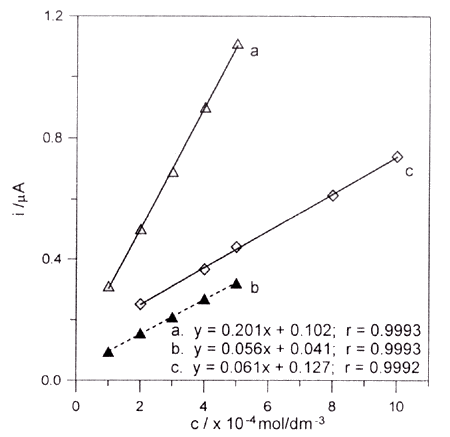
W roztworach tych występowały trzy piki przy potencjałach około +0,58, +0,16 i +0,27V (Au-EQCM), +0,76, +0,58 i -0,36V (PtE) oraz jeden pik przy potencjale +1,15V (GCE). Do celów analitycznych najlepsze były piki anodowe przy potencjałach +0,58V i +0,78V (PtE), dla których uzyskano liniową zależność natężenia prądu od szybkości polaryzacji elektrody i od stężenia karbimazolu w roztworze, co wskazuje na dyfuzyjny charakter obserwowanych procesów. W buforze boranowym o pH 10,85 dopiero po około 15 minutach pojawił się na woltamperometrze jeden pik przy potencjale +0,38V.
Aktywność elektrodową karbimazolu na elektrodach dyskowych obserwowano w zakresie pH 1 do 6 (dE/dpH=150mV). W roztworach o pH > 9 rozpoczynała się hydroliza alkaliczna prowadząca do dekarboksylacji cząsteczki karbimazolu, w wyniku której powstawał 1-metyloimidazolo-2-tiol, czynny elektrochemicznie. Jest to zgodne z naszymi poprzednimi badaniami przeprowadzonymi na elektrodach rtęciowych. Proces ten przebiegał zgodnie ze schematem reakcji pierwszego rzędu.
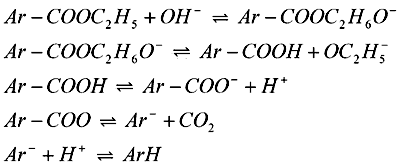
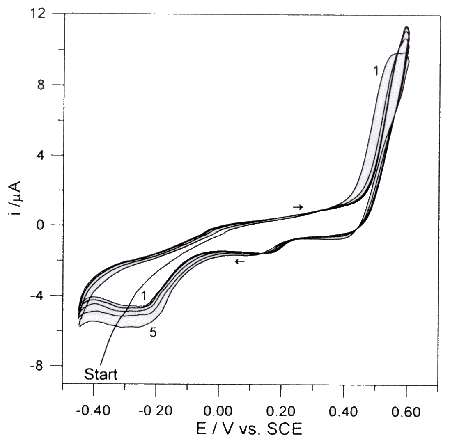
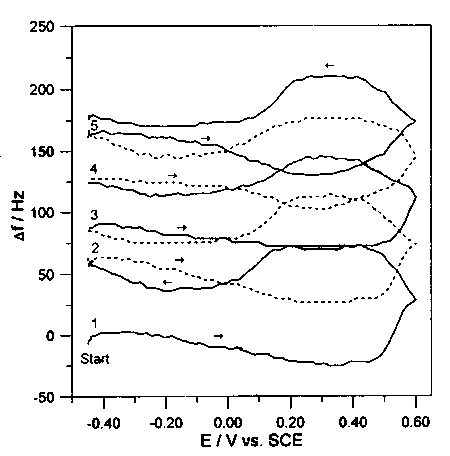
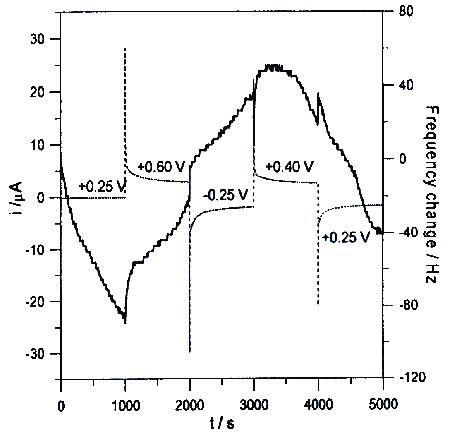
W badaniach metodą EQCM stwierdzono, że wydzielanie produktów utleniania karbimazolu na elektrodzie złotej przebiegało znacznie wolniej niż dla badanych przez nas poprzednio związków zawierających w cząsteczce grupę sulfhydrylową. Proces ten można było obserwować jedynie przy szybkościach polaryzacji elektrody 5 mV s-1 i mniejszych. Całkowita masa produktów utleniania karbimazolu, wydzielana w pierwszym cyklu wynosiła 95 ng (około 15 razy mniej niż w przypadku metimazolu), a w następnych cyklach po około 75 ng. Produkty powstające podczas elektrolizy ulegały niewielkiej adsorpcji na powierzchni elektrody złotej. Podczas polaryzacji katodowej przy potencjale +0,20V rozpoczynała się desorpcja i częściowe usunięcie produktów reakcji utleniania. W badaniach chronowoltamperometrycznych (rys 5) stwierdzono, że najszybsza usuwanie produktów reakcji z powierzchni elektrody zachodziło przy potencjale +0.25V, przy którym przebiegał proces redukcji widoczny na woltamperometrycznej krzywej cyklicznej (rys 3).
Mechanizmy utleniania związków organicznych, zawierających ugrupowanie tiokarbonylowe czy sylfhydrylowe na elektrodach z metali szlachetnych są komplikowane procesami adsorpcji, a w szczególności na elektrodzie platynowej, ze względu na znaczny udział w reakcjach tlenków z powierzchni elektrody. W pierwszym etapie powstają rodniki Ar-S, które mogą dimeryzować tworząc dwusiarczki. Dalsze utlenianie zaadsorbowanych rodników prowadzi do powstawania odpowiednich kwasów sulfonowych.
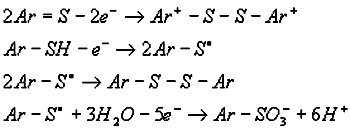
Opisane powyżej badania wykazały, że najlepsza do ilościowych oznaczeń karbimazolu jest elektroda platynowa, na której uzyskano najbardziej powtarzalne krzywe. Stwierdzono również, że elektrochemiczna mikrowaga kwarcowa EQCM ze standardowymi kryształami 10 MHz pozwala na badanie procesów elektrodowych z dużą czułością i dokładnością, nawet przy niewielkich zmianach masy elektrody.